|
Chemie |
|
 |
Naturwissenschaften |
|
|
Radiochemischer
Nachweis von superschweren Elementen
|
 |
 |
|
Superschweres
Element 112 chemisch untersucht
|
 |
 |
| " Einem
internationalen Forschungsteam mit wesentlicher Beteiligung des Paul Scherrer
Instituts (PSI) und der Universität Bern ist es gelungen, mit zwei
Atomen des künstlichen Elements 112 chemische Untersuchungen durchzuführen.
Damit haben sich die Wissenschaftler erstmals experimentell auf der Insel
der superschweren Atomkerne im Periodensystem bewegt.
Diese Pionierleistung
in der Radiochemie zeigt, dass sich das Element 112 ähnlich verhält
wie das flüchtige Schwermetall Quecksilber. |
|
|
 |
«Wir
sind erfolgreich auf der Insel gelandet», sagen freudig die Initiatoren
des Projekts, Heinz Gäggeler, Forschungsbereichsleiter am PSI und
Chemieprofessor an der Universität Bern, und Robert Eichler, Leiter
der Schwerelementforschung am PSI.
Schon
seit einigen Jahren produzieren Physiker am russischen Kernforschungszentrum
Dubna in Kernfusionsreaktionen neue Isotope,
die sie auf Grund ihrer radioaktiven Zerfallseigenschaften der theoretisch
vorhergesagten Insel der superschweren Atomkerne zuordnen. Eine solche
Insel im Periodensystem ist nicht nur durch die Zahl der Protonen (Ordnungszahl),
sondern auch durch die Zahl der Neutronen (Isotope)
in ihren Atomkernen vom Gebiet bekannter Elemente abgesetzt. Doch bisherige
Versuche in den USA, diese Entdeckungen experimentell zu bestätigen,
schlugen fehl. Der Grund liegt darin, dass von den neuen Elementen sich
nur wenige Atome pro Woche herstellen lassen. Sie werden künstlich
an einem Schwerionenbeschleuniger erzeugt, indem radioaktives Material
mit hochenergetischen Strahlen aus Kalzium bestrahlt
wird.
nach
oben
 |
| Das
internationale Team mit Forschern des PSI und der Universität Bern
hat im Rahmen eines vom Schweizerischen Nationalfonds unterstützten
Projekts nun einen Durchbruch geschafft. Mitgearbeitet haben auch Wissenschaftler
aus dem Dubnaer Kernforschungszentrum und dem Institut für Elektronische
Technologie in Warschau. Während zwei Monaten wurde in Dubna ein Target
aus Plutonium mit hochintensiven Strahlen
aus Kalzium bombardiert. |
|
Experiment
mit zwei Atomen gelungen
Mit
dem Experiment wollte das Forschungsteam die Entstehung des neutronenreichen Isotops des Elements 112 in dieser Kernreaktion erstmals unabhängig bestätigen
und das Atom gleichzeitig chemisch untersuchen. Theoretische Berechnungen
sagen für Element 112 ein chemisches Verhalten voraus, das sich zwischen
demjenigen von Quecksilber als einem flüchtigen Schwermetall
und demjenigen von Radon als einem Edelgas bewegt.
 |
| Der
Versuch in Dubna verlief erfolgreich. Am 11. Mai 2006 gegen drei Uhr früh
sowie am 25. Mai um halb neun Uhr morgens Moskauer Zeit gelang es, den
Zerfall zweier Atome von Element 112 zu beobachten, wobei die Zerfallscharakteristik
eindeutig mit den bisherigen Beobachtungen übereinstimmte.
Die Atome
des Elements 112 zerfielen durch Emission eines Alphateilchens in das Isotop
des Elements 110 mit der Massenzahl 279, das etwa eine halbe Sekunde später
durch eine spontane Kernspaltung zerplatzte. |
|
Die
gemessene Energie der beiden Bruchstücke aus der Kernspaltung war
wie erwartet erheblich grösser als die entsprechende Energie aus der
bekannten Kernspaltung von Uran, wie sie
in jedem Kernkraftwerk genutzt wird.
Interessanterweise
verhielten sich die zwei Atome vom Element 112 im Experiment wie ein flüchtiges
Schwermetall, also ähnlich wie Quecksilber, und nicht wie Radon.
Dem internationalen Forschungsteam ist somit eine erste chemische Untersuchung
auf der Insel der superschweren Elemente gelungen.
 |
| Quelle:
Paul Scherrer Institut (PSI), 2006 |
nach
oben
 |
| Isotop
(gr: isos = gleich, topos = gleicher Ort)
Als
Isotope werden Atome bezeichnet, welche die gleiche Elektronen- und Protonenzahl
haben, sich aber in der Anzahl ihre Neutronen unterscheiden. Diese Atome
zeigen gleiche chemische Eigenschaften. Ihre Atommassenzahlen sind jedoch
unterschiedlich. Isotope stehen daher an derselben Stelle im Periodensystem
der Elemente.
Viele
Elemente sind Mischungen verschiedener Isotopenarten (Bsp.: Kohlenstoff
mit dem bekanntesten Isotop 14C, 14 = Atommassenzahl). Diese Elemente sind
als Mischelemente ein Isotopengemisch. Reinelemente wie Fluor,
Natrium bestehen aus nur einer Atomart. Sie enthalten keine Isotope. |
|
nach
oben
|
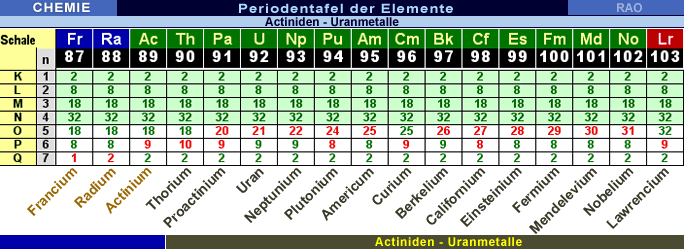
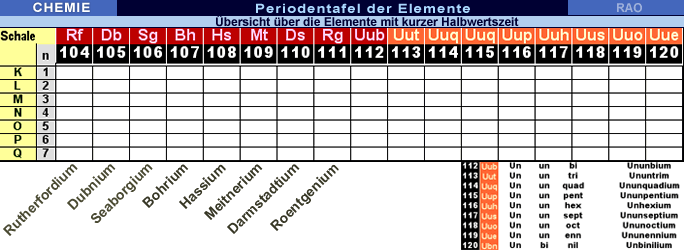
Periodensystem
der Elemente: Schwerelemente
|
 |
nach
oben
|
Links
|
 |
 |
 |
Externe
Links |
 |
| PSI
Forum |
CERN The world's largest particle physics laboratory (e/f)
Webelements Periodic table (engl) - Periodentafel der Elemente |
|
| Weitere Informationen |
 |
|